|
![]()
La
materia. Propiedades características
Materia es todo aquello que tiene masa y ocupa un lugar en el espacio. Estas características de la materia ya fueron estudiadas desde antiguo:
El compañero que se sienta junto a ti está constituido por materia, lo mismo que la silla en la que se sienta, la mesa que usa para escribir y las hojas de papel que emplea para tomar apuntes. Reciben el nombre de cuerpos a una porción de materia, delimitada por unas fronteras definidas, como un folio, el lápiz o la goma de borrar; varios cuerpos constituyen un sistema material.
Aunque todos los cuerpos están formados por materia, la materia que los forma no es igual, ya que hay distintas clases de materia: la materia que forma el papel es distinta de la que forma el agua que bebemos o de la que constituye el vaso que contiene el agua. La materia que forma el asiento de la silla es distinta de la que forma sus patas o de la que forma el suelo en el que se apoya. Cada una de las distintas formas de materia que constituyen los cuerpos recibe el nombre de sustancia. El agua, el vidrio, la madera, la pintura ... son distintos tipos de sustancias.
Cuando miramos a nuestro alrededor, podemos distinguir las distintas clases de materia que forman los cuerpos que nos rodean. Así distinguimos la madera, el plástico y la pintura de la silla que usamos para sentarnos, el vidrio y el aluminio de la ventana, etc. Sabemos que todas esas sustancias son materia y que cada una de ellas es distinta a las demás. Si todas son materia, han de tener algo en común, alguna propiedad que nos permite afirmar que todas ellas son materia. Por otro lado, como podemos distinguir una sustancia de otra, también debe haber algo que nos permite diferenciarlas. Ese algo que nos permite identificar y distinguir las cosas recibe el nombre de propiedad. Propiedad es una característica o atributo de un objeto o una sustancia que nos permite clasificarla como igual o distinta a otra.
Hierón II, rey de Siracusa en el siglo III a.C. y pariente de Arquímedes, tenía suficiente confianza en él para plantearle problemas aparentemente imposibles. Cierto orfebre le había fabricado una corona de oro. El rey no estaba muy seguro de que el artesano hubiese obrado rectamente; podría haberse guardado parte del oro que le habían entregado y haberlo sustituido por plata o cobre. Así que Hierón encargó a Arquímedes averiguar si la corona era de oro puro [...] .

Arquímedes no sabía qué hacer. El cobre y la plata eran más ligeros que
el oro. Si el orfebre hubiese añadido cualquiera de estos metales a la
corona, ocuparían un espacio mayor que el de un peso equivalente de oro.
Conociendo el espacio ocupado por la corona (es decir, su volumen)
podría contestar a Hierón, lo que no sabía era cómo averiguar el volumen
de la corona.
Arquímedes siguió dando vueltas al problema en los baños públicos.[...]
De pronto se puso en pie como impulsado por un resorte: se había dado
cuenta de que su cuerpo desplazaba agua fuera de la bañera. El volumen
de agua desplazado tenía que ser igual al volumen de su cuerpo. Para
averiguar el volumen de cualquier cosa bastaba con medir el volumen de
agua que desplazaba. [...]
Arquímedes corrió a casa, gritando una y otra vez: "¡Lo encontré, lo
encontré!". Llenó de agua un recipiente, metió la corona y midió el
volumen de agua desplazada. Luego hizo lo propio con un peso igual de
oro puro; el volumen desplazado era menor. El oro de la corona había
sido mezclado con un metal más ligero, lo cual le daba un volumen mayor.
El rey ordenó ejecutar al orfebre. (En "Momentos estelares de la
ciencia" de Isaac Asimov)
Ejemplo Interactivo
Coloca la corona y el trozo de oro cada uno en un platillo de la balanza.
Este tema trata de las
propiedades llamadas características, porque son específicas para cada
sustancia pura; por ello puede identificarse una sustancia desconocida,
ya que pueden reconocerse sus propiedades y luego compararlas con las
que en literatura química se describen como características de las
sustancias conocidas.
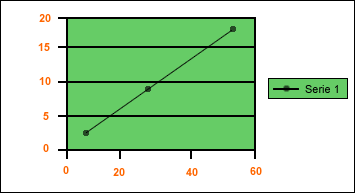
| Densidad: ésta es una propiedad característica de las sustancias y depende de la masa y del volumen correspondiente a una determinada cantidad de materia; mientras mayor sea la cantidad de materia contenida en una unidad de volumen, mayor será la densidad de esa sustancia y viceversa. La relación masa/volumen es un valor constante para cada sustancia, a presión y temperatura constantes. Densidad de algunas sustancias |
|
|
|
¿Cómo podemos determinar la densidad? Para determinar la densidad de una sustancia se pueden tomar varias muestras de ésta y luego medir en cada muestra tanto la masa como el volumen correspondiente, para así calcular la relación masa/volumen o densidad. Los valores pueden resultar con mínima diferencia, porque pueden cometerse errores al realizar las medidas, pero los valores deben ser muy próximos entre sí. |
|
D = 8,1g/3cc
|
D = 24,3g/9cc
|
D = 48 ,6g/18cc
|
|
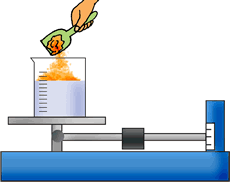
Punto de ebullición: Cuando calentamos un líquido, la temperatura va aumentando y se produce un burbujeo. En este punto la temperatura permanece constante, y normalmente decimos que el líquido está hirviendo o bullendo y pasa a la forma de gas; es decir, se evapora. ¿Cómo se determina el punto de ebullición? |
|
|
Punto de fusión
Ocurre cuando se calienta un sólido y su temperatura aumenta hasta que comienza a fundirse y pasa a la forma de líquido; aquí la temperatura permanece constante hasta que el sólido se funde completamente. ¿Cómo se determina el punto de fusión? |
|

¿Cómo se determina la solubilidad?
Se determina añadiendo el soluto a 100 cm 3 de solvente hasta
que ocurra la saturación del solvente, todo ello a una temperatura fija;
después calculamos por pesada la cantidad de soluto disuelta y
expresamos la solubilidad como g de soluto/100cm 3 de solvente.
|
Peso es la fuerza de atracción
que ejerce la gravedad de la tierra sobre la masa de los
cuerpos.
|
La masa se mide con un instrumento llamado balanza; el procedimiento para medir la masa en una balanza debe tomar en cuenta el estado físico del material.
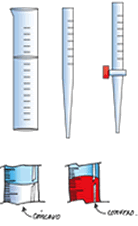
El volumen se mide en cualquier instrumento volumétrico; puede ser el cilindro graduado, la pipeta, la bureta u otro similar; en todo caso la lectura correcta del volumen en el instrumento debe tomar en cuenta la posición del menisco.
tomado de:
ARDILA, C., BRACHO, E., NÚÑEZ, A. y SALAZAR, A. (1.974).
Química General . Madrid. Ediciones Vega s.r.l.
Codesis. (2.001). Química (CD-ROM). (Computer software).
FERNÁNDEZ, M. y LOPEZ, D. (1.993). Química 9ª grado . Caracas .
Editorial Triángulo.
GUARDIA, M.
THE NATIONAL SCIENCE FOUNDATION. Chemical Education Material Study.
(1.966). Versión española del Prof. Dr. Rafael USN. Universidad de
Oviedo. Química: Una ciencia experimental . Barcelona, España. Editorial
Reverté, S.A.
VASQUEZ, J.M.
www.proyectosalonhogar.com
