|
|
Mezclando
sustancias
|
Muy pocos elementos
están hechos de un solo elemento químico o
compuesto. La mayoría son mezclas; es decir, una
combinación de dos o más sustancias puras cuya
composición es variable (plástico, aire, piedra,
agua, etc.). Las mezclas pueden clasificarse en
heterogéneas, que son aquellas mezclas no
uniformes y con partes físicamente distintas; y
las mezclas homogéneas, que son mezclas
uniformes en su totalidad y suelen llamarse
solución. La mezcla homogénea de metales se
denomina aleación.
Con la técnica adecuada, los elementos y
compuestos de una mezcla pueden ser a menudo
aislados. Comprobemos cómo se puede hacer esto.
Actividad: destilación
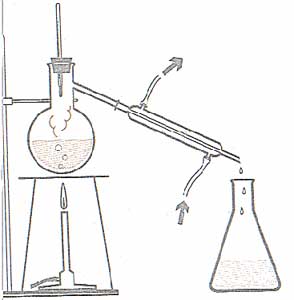 La
destilación es la manera más fácil para separar
elementos sólidos de líquidos. Es un antiguo
proceso que se ha utilizado con frecuencia para
conseguir productos como aceite y alcohol. La
destilación es la manera más fácil para separar
elementos sólidos de líquidos. Es un antiguo
proceso que se ha utilizado con frecuencia para
conseguir productos como aceite y alcohol.
El experimento que a continuación te mostramos,
te enseñará cómo separar la sal del agua. Los
elementos que necesitarás son: una olla pequeña,
una tapa de olla (más grande que la de la olla
que utilizarás), mechero, trípode, tiesto, sal y
agua.
|
(Paso 1) Lo primero que debes
hacer es elaborar una solución salina,
que se logra disolviendo la sal en el
agua. Probándola, tú mismo te darás
cuenta de la concentración de sal que
posee. Luego, vierte la solución salina
en la olla y colócala al fuego. Cubre la
olla con la tapa, dejándola inclinada. |
|
(Paso 2) Coloca el tiesto
bajo el borde de la tapa para
recoger las gotas de agua. Al
calentarse la solución salina,
el agua se evapora y se condensa
en la tapa, separándose de la
sal. La condensación, que
produce un goteo desde la tapa
al tiesto, es agua pura y esto
lo puedes comprobar probando el
agua. |
|
|
|
|
|
|
Ya sabes que todo
lo que existe en el universo está compuesto por
materia. Esta, a su vez, se clasifica en
mezclas y sustancias puras.
Las sustancias puras comprenden un solo compuesto, y las
mezclas son combinaciones de sustancias puras en
proporciones variables o diferentes; por ejemplo,
una mezcla de arena y sal.
Los compuestos están conformados por los elementos
(como, por ejemplo, el hidrógeno y el oxígeno, que
forman el agua), los cuales existen en los compuestos en
una proporción definida, es decir, en cantidades
suficientes que permiten que dichos elementos se
mantengan siempre estables y que también impiden su
separación por métodos físicos. Por ejemplo, si se hace
reaccionar sodio (Na) con cloro (Cl2) se obtendrá Na1Cl1
exclusivamente y no sustancias tales como Na0.5Cl2.3 o
mezclas raras.
Las mezclas se clasifican en homogéneas
(soluciones) y en heterogéneas. En una
mezcla homogénea no hay distinción de fases, es decir,
de una porción de la sustancia pura. Es el caso, por
ejemplo, del agua con alcohol, el agua azucarada o el
agua con café, donde se observa una sola fase: la
líquida. Además, en este tipo de mezcla los componentes
se unen hasta el nivel molecular, de manera que no es
posible distinguirlos. Por ejemplo: oxígeno en
agua o sal en agua. También existen las
soluciones sólidas (mezcla de metales), llamadas
aleaciones.
En las soluciones hay dos sustancias involucradas: una
que disuelve, solvente, y otra que se
disuelve, el soluto. Cuando mezclamos
agua (solvente) con azúcar, tenemos que cada molécula de
azúcar (soluto) queda rodeada por varias moléculas de
agua. Lo mismo sucede en otras soluciones. Por esta
razón, una vez que han sido mezclados no podemos
diferenciar a simple vista el soluto del solvente.
En cambio, en una mezcla heterogénea pueden distinguirse
con facilidad las diferentes fases que forman la mezcla.
Por ejemplo, el agua con arena. Aquí se forman dos
fases: una fase sólida, conformada por
la arena, y otra fase líquida,
constituida por el agua. Otros ejemplos son el agua con
aceite, sal y arena, entre otros.
Las mezclas pueden separarse en sus componentes
por procesos físicos, mientras que los
compuestos se separan en sus constituyentes por procesos
químicos. En cualquier caso, la mezcla de materiales es
un proceso que utilizamos a diario, tanto en la cocina
(al mezclar los ingredientes de una torta) como en las
industrias altamente tecnificadas (como la
farmacéutica). En la naturaleza también encontramos
mezclas, como la sangre, la orina y el aire.
Separación
de las mezclas |
|