|
Reacciones Químicas
Isometría |
Isómeros: son compuestos que teniendo la
misma fórmula molecular, presentan propiedades
diferentes, debido a que presentan diferente
fórmula estructural. |
|
Isómeros estructurales:
Isómeros de cadena: estos isómeros se
presentan en compuestos que difieren en la
posición de los átomos en la cadena carbonada.
Estos isómeros son característicos de los
alcanos y cicloalcanos. |
En la siguiente figura se observan isómeros de
alcanos alifáticos: |
Fórmula bruta: C4H10
|
En la siguiente figura se observan isómeros de
alcanos cíclicos. |
Fórmula bruta: C8H16
|
Isómeros de posición:
estos compuestos presentan la misma cadena o
anillo y los mismos grupos funcionales, pero
difieren en la posición o posiciones a las
cuales están unidos esos grupos, por lo que las
propiedades físicas e incluso las químicas
varían. |
|
Fórmula
bruta: C4H9
(OH) |
Fórmula
bruta: C4H8
(OH) |
|
|
Isómeros de función:
estos isómeros se distinguen por presentar
grupos funcionales diferentes. Los isómeros se
presentan entre compuestos diferentes tales
como: dienos y alquinos, aquenos y cicloalcanos,
aldehídos y cetonas, alcoholes y éteres, ácidos
y ésteres, entre otros. |
Fórmula
bruta: C4H6
Alquino isómero de dieno |
Fórmula
bruta: C3H6
Alqueno isómero de
cicloalcanos
|
|
|
Isómeros Espaciales:
Isómeros geométricos: en un compuesto
orgánico la rotación alrededor de un enlace
simple carbono-carbono es libre, esto permite
que los átomos de dicho compuesto tomen
posiciones relativas formando las denominadas
conformaciones.
La diferencia energética para alcanzar una
configuración u otra es muy pequeña apenas de 6
a 6 Kcal/mol, esto hace imposible asilar las
diferentes conformaciones de los compuestos que
presentan enlaces simples.
Cuando se trata de compuestos con doble enlace
carbono-carbono, la rotación está restringida
por la cantidad de energía. El doble enlace es
rígido y sólo puede producirse si el doble
enlace se rompe, para lo cual es necesario
alrededor de 70 Kcal/mol.
Los isómeros geométricos contienen los mismos
rasgos estructurales, los mismos grupos
atómicos, los mismos ángulos de enlace y están
unidos a las mismas posiciones en anillos
idénticos o estructuras de cadenas idénticas,
solo se diferencia en alguno de los grupos en el
espacio, por lo que se les llama
estereoisómeros. |
|
Configuración CIS: esta configuración se
presenta cuando grupos idénticos (hidrógenos,
halógenos, etc.) aparecen en un mismo lado del
plano que pasa por los dos carbonos por el doble
enlace y es perpendicular al plano de la
molécula. |
Configuración TRANS: esta configuración
se presenta cuando los dos grupos idénticos
aparecen en lados opuestos de ese plano. |
|
Los isómeros geométricos de una sustancia
determinada pueden ser separados
experimentalmente, debido a que su configuración
les otorga propiedades físicas que los
diferencian. Es así que los isómeros Cis son más
polares, presentan punto de ebullición más altos
y punto de fusión más bajo. |
Isómeros Ópticos: Los isómeros ópticos
son sustancias que física y químicamente son
iguales, su diferencia se encuentra en que
desvían un rayo de luz polarizada en distinto
sentido. Si la desvían en el sentido de las
agujas del reloj (hacia la derecha) se denomina
compuesto dextrógiro y se representa con el
signo (+), si lo hacen en sentido contrario
(hacia la izquierda) se denomina compuesto
levógiro (-).
La luz sin polarizar vibra en muchas direcciones
que se resuelven en planos perpendiculares entre
si.
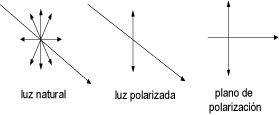 |
Para polarizar la luz se usa un prisma de
Nicol que consiste en dos cristales de calcita
(CaCO3) unidos por bálsamo de Canadá.
Cuando la luz atraviesa el prisma se divide en
dos rayos: uno ordinario que vibra en el plano
del papel y que es reflejado totalmente por la
capa del bálsamo de Canadá y otro extraordinario
que emerge del prisma y vibra en planos
paralelos (en un solo plano). Este último es el
rayo de luz polarizada y es el que se hace
incidir sobre la sustancia cuya desviación
óptica se quiere medir y para lo cual se utiliza
el polarímetro.
El polarímetro consta de dos prismas de Nicol,
uno llamado polarizador y el otro llamado
analizador, éste último puede ser girado y
presenta una escala graduada que permite medir
en grados el signo y la amplitud de la
desviación que experimenta el rayo de luz
polarizada. El número de grados el signo y la
amplitud de la desviación que experimenta el
rayo de luz polarizada. El número de grados de
la rotación depende de la naturaleza de la
sustancia disuelta, de la distancia (longitud
del recorrido) que recorre la luz a través de la
solución y de la concentración de la solución.
El poder óptico rotatorio de una sustancia viene
dado por la falta de simetría de sus moléculas
debido, generalmente, a la existencia de un
carbono asimétrico. |
|
Un carbono asimétrico es aquel que está unido a
cuatro sustituyentes diferentes. |
Un isómero óptico es la imagen especular del
otro (imagen opuesta tipo espejo), ambos reciben
el nombre de enantiómeros, enantiomorfos o
antípodas ópticas. |
|
Los enantiomorfos presentan las mismas
propiedades químicas y físicas (excepto su
acción sobre la luz polarizada). Una mezcla
equimolecular (igual número de moléculas) de dos
enantiomorfos no presentará actividad óptica. A
esta mezcla se le llama
mezcla racémica. |
REFERENCIAS:
Requeijo, D. y Requeijo A. (2002). Química .
Editorial Biosfera.
Irazábal A. y de Irazábal C. (S/A). Química.
Ediciones CO-BO.
Mahan. Química. (1977). Fondo Educativo
Interamericano. |