|
Reacciones
químicas
y
Energía Calorífica |
1 caloría
= 4.184 joules = 4.184 J
1 Kilocaloría = 1.000 calorías = 1 Kcal
|
|
El calor de reacción: es el cambio de
energía que se presenta del rompimiento o
formación de enlaces químicos. El calor de
reacción se expresa generalmente en términos de
calorías o kilocalorías (Kcal). Actualmente
también se utiliza el joule (J) como medida de
energía cuando se habla de cambios químicos. |
El calor de reacción puede recibir diferentes
nombres según el tipo de cambio que se produce
en la reacción. Puede nombrarse entonces como:
calor de formación, calor de combustión, calor
de neutralización, etc. |
Reacciones exotérmicas y reacciones endotérmicas:
Durante las reacciones químicas puede producirse
absorción o liberación de energía. Esto indica
que tanto los reaccionantes como los productos
contienen calor que es característico de su masa.
El contenido de calor es una medida de la
energía que está acumulada por una sustancia
durante su formación. |
|
|
Reacciones endotérmicas: son aquellas
reacciones que absorben calor, lo que significa
que la energía de las moléculas de los productos
(EP) es mayor que la energía de las moléculas de
los reaccionantes (ER).
La reacción para obtener N2O es un
proceso endotérmico que requiere calor para unir
al nitrógeno y el oxígeno, la cantidad de calor
se representa en Kcal.
2N2(g) + O2(g) + 39 Kcal  2N2O(g)
2N2O(g) |
Reacciones exotérmicas: son aquellas
reacciones donde se libera calor, esto significa
que la energía de las moléculas de los productos
(EP) es menor que la energía de las moléculas de
los reaccionantes (ER).
La combustión del metano es una reacción de tipo
exotérmico: CH4(g) + 2O2(g)
 CO2(g)
+ 2H2O(g) + 213 Kcal. CO2(g)
+ 2H2O(g) + 213 Kcal. |
|
| |
Energía calorífica y temperatura: Si una
muestra de agua a una temperatura conocida (Temperatura
inicial = Ti) se calienta durante un cierto
tiempo, se observa un incremento de su
temperatura. Al medir la nueva temperatura se
obtiene la Temperatura final (Tf), la variación
de la temperatura en la muestra se calcula
restando la Tf menos la Ti y el resultado se
denomina
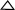 T. T.
La temperatura representa una medida de
intensidad de calor, pero no es una medida de
energía calorífica, pues la energía calorífica
se expresa en calorías.
1 caloría es la cantidad de calor que absorbe
1 g de agua para elevar su temperatura de 14,5ºC
a 15,5 ºC .
Así, el Calor:
es la transferencia de energía entre dos
sistemas a diferentes temperaturas.
Al igual que el agua cada sustancia tiene una
capacidad determinada para absorber calor, es
decir tiene una capacidad calorífica propia.
Capacidad calorífica:
es la cantidad de calor que se requiere para
elevar a 1ºC la temperatura de 1 mol de
sustancia. |
Cuando se compara la capacidad calorífica de una
sustancia con la del agua, que tiene el valor de
la unidad, se obtiene un valor denominado calor
específico.Calor
específico (Ce): es la cantidad de calor
necesaria para aumentar en 1ºC la temperatura de
1 gr de sustancia. |
Calores específicos de algunas sustancias o
elementos:
|
Sustancia o elemento químico |
Calor
específico (cal/gºC) |
|
Agua |
|
Alcohol etílico |
|
Aluminio |
|
Hierro |
|
Cobre |
|
Calcio |
|
Magnesio |
|
|
1,00 |
|
0,511 |
|
0,217 |
|
0,113 |
|
0,093 |
|
0,149 |
|
0,248 |
|
|
El calor ganado por un sistema se determina
mediante la siguiente ecuación: |
|
|
Q = sistema
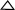 T =
Diferencia de la temperatura final – temperatura
inicial T =
Diferencia de la temperatura final – temperatura
inicial
M= Masa de la sustancia sobre la cual se produce
el cambio de temperatura.
Ce = Calor específico de la sustancia.
|
|
Ejemplo 1:
Calcule la cantidad de calor absorbida
por 200 g de agua cuando son calentados
desde 20 ºC hasta 80 ºC . |
 |
| Si
queremos llevar el valor obtenido a
Kcal, solo debe realizarse una simple
regla de tres tomando en cuenta que: 1
Kcal es igual a 1.000 cal.: |
 |
Si se
desea expresar la cantidad de calor en
Joules, es necesario recordar que 1
caloría es igual a 4,184 j/cal, por lo
cual basta con multiplicar la calidad de
calorías por este número:
|
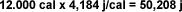 |
Ejemplo 2:
El uso de las ecuaciones ya estudiadas
también permite investigar la
temperatura final de una mezcla de la
misma sustancia a diferentes
temperaturas, así:
Se mezclan 50 g de agua a 90 ºC con 150
g de agua a 30 ºC . Calcular la
temperatura final de la mezcla: |
| La
cantidad de calor cedida por el agua
caliente es igual a la masa de agua por
la diferencia de temperatura: |
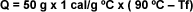 |
| Y la
cantidad de calor ganada por el agua
fría también será igual a la masa de
agua por la diferencia de temperatura:
|
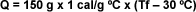 |
| Esto
permite unir ambas ecuaciones y obtener
una sóla ecuación con una incógnita: |
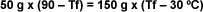 |
|
Despejando: |
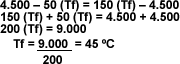 |
Ejemplo 3:
El uso de las ecuaciones permite también
determinar cuanta energía es liberada
durante el enfriamiento de una sustancia,
pero en este caso se aplicará un nuevo
término, la capacidad calorífica molar.
Capacidad
calorífica molar: se define como
la capacidad calorífica por mol
(cal/mol). |
¿Cuánta energía se
libera cuando se enfrían 50 g de plomo
desde 150 ºC hasta 50 ºC , si su
capacidad calórica molar promedio en
este intervalo de temperatura es de 6,42
cal/mol ºC.
Transformación de los la masa de la
sustancia de gramos a moles:
Mol de plomo = gramos de plomo / masa
atómica del plomo. |
 |
| El
signo negativo indica que se desprende
calor, la temperatura final es menor que
la temperatura inicial. |
|
| |
Entalpía: es el
contenido calórico de una sustancia y se
representa con la letra H. La variación de
entalpía en un sistema químico ,
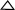 H,
es igual a la entalpía de los productos
resultantes, H2 , menos la entalpía
de los productos reaccionantes, H1 . H,
es igual a la entalpía de los productos
resultantes, H2 , menos la entalpía
de los productos reaccionantes, H1 .
 H =
H2 – H1 H =
H2 – H1
|
Cuando el benceno reacciona con el oxígeno se
desprenden 780 Kcal por cada mol de benceno
consumido:
|
Esta ecuación termodinámica difiere de las
ecuaciones ordinarias ya que en ella se indica
el estado físico de cada sustancia: liq =
líquido, g = gaseoso. Se señala la variación de
entalpía en el proceso y la ecuación se iguala
tomando 1 mol de una sustancia como patrón. En
este caso para la combustión de 1 mol de benceno
se han utilizado, exactamente, 7 y ½ moles de
oxígeno.
El  H
de la reacción es de -780 kcal. Esto indica que
la energía de 3 moles de agua y seis de dióxido
de carbono es 780 kcal menor que la contenida en
un mol de benceno y siete y medio de oxígeno. Es
por ello que el signo de la variación de la
entalpía es negativo. H
de la reacción es de -780 kcal. Esto indica que
la energía de 3 moles de agua y seis de dióxido
de carbono es 780 kcal menor que la contenida en
un mol de benceno y siete y medio de oxígeno. Es
por ello que el signo de la variación de la
entalpía es negativo.
Un  H
negativo indica que hay desprendimiento
de calor, es decir se trata de una reacción
exotérmica. H
negativo indica que hay desprendimiento
de calor, es decir se trata de una reacción
exotérmica. |
La ecuación para la descomposición del óxido de
níquel: |
|
Esta ecuación muestra que se absorben 57 Kcal,
es decir, que la energía de un mol de níquel y
de ½ mol de oxígeno es 57 kcal mayor que la de
un mol de óxido de níquel.
Un
 H
positivo indica que hay absorción de
energía, es decir se trata de una reacción
endotérmica. H
positivo indica que hay absorción de
energía, es decir se trata de una reacción
endotérmica. |
Diagramas de Entalpía:
estos diagramas permiten observar gráficamente
los niveles de energía de los productos
reaccionantes y de los productos.
|
|
En una reacción endotérmica, el nivel energético
de los reaccionantes es inferior que el de los
productos formados en la reacción. El sistema
gana energía. |
En una reacción exotérmica, el nivel energético
de los productos es superior al de los
reaccionantes. El sistema pierde energía. |
|
| Ley de
la actividad de los calores de reacción:
Las ecuaciones termodinámicas poseen dos
propiedades muy importantes: |
1.-
Pueden invertirse, lo que hará que
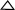 H cambie de signo. Ejemplo:
H cambie de signo. Ejemplo: |
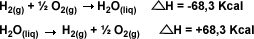 |
| 2.-
Pueden sumarse y restarse como
ecuaciones algebraicas. Esta es una
generalización de la aplicación de la
ley de Hess. Por ejemplo, la adición de
dos ecuaciones termodinámicas: número: |
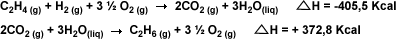 |
| Esta
ecuación permite predecir que el calor
de hidrogenación del eteno (C2H4
(g)) para producir etano (C2H6
(g)) es: |
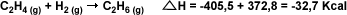 |
|
Aplicación de la Ley de Hess:
Aplicando la Ley de Hess es posible calcular
la variación entálpica de una reacción:
Ejemplo:
Calcule la variación entálpica (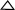 H)
para la formación de agua líquida a
partir del hidrógeno y oxígeno gaseosos: H)
para la formación de agua líquida a
partir del hidrógeno y oxígeno gaseosos:
|
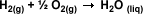 |
| Conociendo las
ecuaciones termodinámicas: |
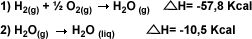 |
| El resultado se
obtiene sumando algebraicamente las
ecuaciones 1 y 2, lo cual elimina el
término H2O(g):
|
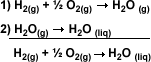 |
La suma de los
 H
dará el H
dará el
 H
de la reacción pedida: H
de la reacción pedida: |
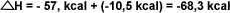 |
Ejemplo 2:
Calcule el
 H
para la formación de HI partiendo del
hidrógeno atómico y yodo atómico: H(g)
+ I(g) H
para la formación de HI partiendo del
hidrógeno atómico y yodo atómico: H(g)
+ I(g)
 HI(g)
, valiéndose de la ecuaciones
termodinámicas: HI(g)
, valiéndose de la ecuaciones
termodinámicas: |
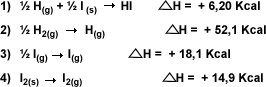 |
Para realizar el
cálculo es necesario operar las
ecuaciones químicas como ecuaciones
algebraicas para eliminar las sustancias
que no aparecen en la ecuación final.
Para ello basta con invertir las
ecuaciones 2), 3) y 4), además de
cambiar los signos delos respectivos
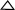 H
y se multiplica la ecuación 4) por ½: H
y se multiplica la ecuación 4) por ½:
|
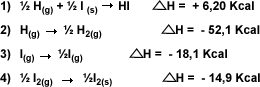 |
La suma de las
ecuaciones y de sus
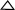 H
da como resultante: H
da como resultante: |
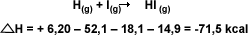 |
|
| |
Entropía: es una
medida del desorden de un sistema y se
representa con la letra S. Así el cambio de
entropía se simboliza con
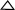 S. S.
Un valor positivo de
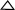 S
indica disminución del grado de distribución
ordenada. Lo que quiere decir que el desorden
aumenta. El S
indica disminución del grado de distribución
ordenada. Lo que quiere decir que el desorden
aumenta. El
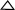 S
positivo se presenta cuando un sólido se
convierte en líquido o gas. Ya que en ambos
casos el movimiento de las moléculas es más
rápido lo cual se traduce como la pérdida de una
distribución ordenada que mantiene más unidas a
las moléculas. S
positivo se presenta cuando un sólido se
convierte en líquido o gas. Ya que en ambos
casos el movimiento de las moléculas es más
rápido lo cual se traduce como la pérdida de una
distribución ordenada que mantiene más unidas a
las moléculas.
Cuando se realiza un cambio de gas a líquido
o de líquido a sólido entonces el
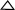 S
es negativo . El cambio de entropía viene
dado por la ecuación S
es negativo . El cambio de entropía viene
dado por la ecuación
Así, la transformación de un mol de agua
líquida (S= 16,72 cal/ºK) en un mol de vapor de
agua (S= 45,11 cal/ºK) dará como consecuencia
una variación de la entropía del sistema de:
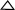 S (reacción)
= 45,11 cal/ºK – 16,72 cal/ºK = 28,39 cal/ºK. S (reacción)
= 45,11 cal/ºK – 16,72 cal/ºK = 28,39 cal/ºK.
El 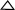 S
positivo es un indicativo de que el grado de
desorden ha aumentado. Las moléculas en fase
gaseosa se trasladan velozmente de un lado a
otro, sin dirección determinada. S
positivo es un indicativo de que el grado de
desorden ha aumentado. Las moléculas en fase
gaseosa se trasladan velozmente de un lado a
otro, sin dirección determinada. |
REFERENCIAS:
Requeijo, D. y Requeijo A. (2002). Química .
Editorial Biosfera.
Irazábal A. y de Irazábal C. (S/A). Química.
Ediciones CO-BO.
Mahan. Química. (1977). Fondo Educativo
Interamericano. |