|
Propiedades Físicas y químicas de los Derivados
Halogenados |
Los derivados halogenados: son compuestos
orgánicos que contienen uno o más halógenos en
su molécula. Se les denomina haluros o
halogenuros . |
|
Los derivados halogenados que contienen un sólo
átomo de halógeno en su molécula se llaman
monohaluros; si contienen dos átomos de halógeno
se llaman dihaluros y si presentan más de dos
átomos de halógeno en su molécula se les llama
polihaluros. |
Los haluros de alquilo
son los derivados halogenados de mayor
importancia, ya que se utilizan como base para
la síntesis de muchos compuestos orgánicos.
|
|
CH3-CH2-CH2-CH3
Butano. Peso molecular: 58CH3-CHI-CH2-CH3
2-iodobutano. Peso molecular: 183,90.En este
compuesto, el yodo (halógeno) sustituye un
hidrógeno de uno de los átomos de carbono. |
Propiedades Físicas de los Haluros de Alquilo:
Los haluros de alquilo presentan densidades y
puntos de ebullición más altos que los de sus
correspondientes alcanos, esto se debe a que la
molécula del alcano aumenta el peso molecular
del halógeno cuando sustituye a un hidrógeno.
|
Para un mismo grupo alquilo, la densidad y el
punto de ebullición aumentan con el aumento del
peso atómico del halógeno. |
|
Halógeno |
Peso atómico |
| Fluor |
19 |
| Cloro |
35,5 |
| Bromo |
80 |
| Yodo |
126,90 |
|
Densidad: Los
cloruros y los fluoruros son menos densos que el
agua, mientras que los bromuros y los yoduros
son más densos que el agua. Para un mismo
halógeno la densidad disminuye a medida que
aumenta el tamaño del grupo alquilo. |
| |
Punto de ebullición:
El punto de ebullición de los haluros de
alquilo aumenta a medida que aumenta el tamaño
del grupo alquilo.
Solubilidad: Los
haluros de alquilo son insolubles en agua y
solubles en compuestos orgánicos debido a que no
forman puentes de hidrógeno.
Densidad y puntos de ebullición de algunos
haluros de alquilo y sus diferencias basadas en
su peso molecular.
| |
|
Fórmula |
Peso molecular
|
Densidad |
Pto. de ebullición ºC |
CH3F
CH3Cl
CH3Br
CH3I |
34
50,5
95
141,90 |
0,920
1,732
2,279 |
-78
-24
5
43 |
CH3CH2F
CH3CH2Cl
CH3CH2Br
CH3CH2I |
48
64,5
109
155,90 |
0,910
1,430
1,933 |
-32
12
38
72 |
|
|
|
Propiedades químicas de los haluros de alquilo:
El ión haluro en la molécula se comporta como
una base de Lewis muy débil, esto hace posible
que sea sustituido fácilmente por bases fuertes
reactivos nucleofílicos . Esta propiedad le
permite reaccionar con muchos reactivos
nucleofílicos orgánicos e inorgánicos para dar
origen a nuevos compuestos orgánicos, mediante
reacciones de sustitución y de eliminación.
|
|
R:Mg+ :X-
Ar:Mg+ :X-
Reactivo de Grinard |
Los haluros de alquilo como los haluros de arilo,
reaccionan con virutas de magnesio en presencia
de éter etílico para producir el reactivo de
Grinard: haluro de alquil o aril magnesio. Este
reactivo es de gran importancia en la síntesis
de los alcanos y del benceno. |
Reacciones de
eliminación: Son las reacciones en las
que se separan dos átomos o grupos de átomos de
una molécula, sin que se produzca al mismo
tiempo la penetración de nuevos átomos o grupos
atómicos. La reacción de eliminación más
importante que se produce con los haluros de
alquilo es en la que éste, reacciona con la
potasa alcohólica para dar un alqueno. |
|
La reacción de eliminación puede dar origen
además a mezclas de alquenos o dar origen a
alquinos.
|
|
Reacciones de sustitución: Son reacciones
en las que un átomo o grupo atómico se separa de
la molécula reaccionante, siendo sustituido por
otro átomo o grupo atómico, que procede del
reactivo atacante. |
Síntesis de los Haluros
de Alquilo: Los haluros de alquilo pueden
obtenerse mediante la halogenación de alcanos,
adición de haluro de hidrógeno a un alqueno,
tratando un alcohol con hidrácido o tratando
haluros de fósforo o cloruro de tionilo. |
Las reacciones de halogenación de alcanos:
son poco convenientes industrialmente ya que lo
que permite obtener son mezclas de isómeros y
productos tanto halogenados como polihalogenados.
|
Tratando un alcohol con un hidrácido: Es
un método que permite la preparación de bromuros
y yoduros. Para preparar los bromuros de alquilo
se calienta el alcohol con ácido bromhídrico
concentrado en presencia de ácido sulfúrico. El
mejor rendimiento se obtiene a partir de los
alcoholes primarios
|
Para preparar cloruros
de alquilo primarios y secundarios, el
alcohol primario y secundario se calienta con
ácido concentrado en presencia de cloruro de
zinc en polvo denominado también reactivo de
Lucas. |
|
Los alcoholes terciarios reaccionan rápidamente
sin requerir el calentamiento del cloruro de
zinc.
|
|
|
Obtención de haluros de
alquilo a partir de alcoholes y haluros de
fósforo o cloruro de tionilo: Los
trihaluros y pentahaluros de fósforo (PX3
y PX5) así como el cloruro de tionilo
(SOCl2) reaccionan con los alcoholes
para producir haluros de alquilo. Esta reacción
produce un buen rendimiento de haluros de
alquilo. |
| |
Otros derivados halogenados de importancia: |
Haluros de Aralquilo: estos compuestos
presentan uno o más átomos de halógenos unidos a
la cadena carbonada lateral del anillo bencénico.
|
|
|
Los haluros de aralquilo se comportan
químicamente como un haluro de alquilo por lo
que presentan reacciones de sustitución
nucleofílica en la cadena lateral. |
Haluros de Arilo (Ar-X):
Estos compuestos presentan uno o más átomos de
halógeno unidos directamente al anillo bencénico.
La unión de estos halógenos al anillo es muy
fuerte por lo que no reaccionan por sustitución. |
Los haluros de arilo pueden obtenerse mediante
la reacción del benceno
con un halógeno en presencia de un
catalizador adecuado. |
|
Los haluros de arilo pueden dar origen a otros
compuestos mediante reacciones de halogenación,
nitración, sulfonación y alquilación.
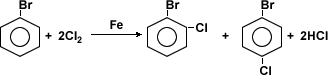
Halogenación
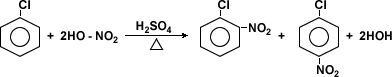
Nitratación
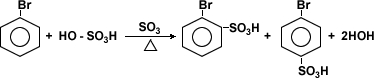
Sulfonación

Alguilación |
|
Reconocimiento de los derivados halogenados en
el laboratorio:
Los derivados halogenados con excepción de los
haluros de arilo, reaccionan con nitrato de
plata en solución alcohólica, produciendo un
precipitado de haluro de plata:
Derivado halogenado
|
Características del Precipitado |
| Fluoruro de plata |
Amarillo pálido |
| Cloruro de plata |
Blanco lechoso |
| Bromuro de plata |
Beige a marrón claro |
| Ioduro de plata |
Amarillo intenso |
|
Otra forma de reconocer los derivados
halogenados en el laboratorio es mediante el
ensayo de Belstein,
que consiste en humedecer un alambre de cobre
con el derivado halogenado y llevarlo a la llama
del mechero,si se trata de un derivado
halogenado la llama se torna de color verde.
Esta reacción no se da en los compuesto
fluorados. |
Bibliografía
Requena, L. Vamos a Estudiar Química Orgánica.
(2001). Ediciones ENEVA Caracas.
Marcano, D., Cortés, L. Química Orgánica.
(1982). Editorial Reverte S.A. |