|
Propiedades físicas y químicas de los
hidrocarburos |
 |
Los hidrocarburos son compuestos orgánicos
formados exclusivamente por carbono e hidrógeno.
|
Explora los enlaces con el cursor |
Los hidrocarburos se clasifican en:
Hidrocarburos saturados, llamados también
alcanos, que presentan enlaces sencillos. Los
alquenos, que tienen enlaces dobles y los
alquinos, con enlaces triples. |
Alcanos:
Los átomos de carbono de un alcano pueden ser
clasificados como: átomo primario cuando
se unen a un carbono, secundario, si se
unen a dos carbonos, terciario, si se unen a
tres o cuaternario si se unen a cuatro. |
Explora los elementos en rojo con el cursor |
Punto de Ebullición |
Propiedades Físicas de
los alcanos:
Punto de ebullición: el punto de
ebullición aumenta con el tamaño del alcano
porque las fuerzas intermoleculares (fuerzas de
Van der Waals y de London), son más efectivas
cuando la molécula presenta mayor superficie. Es
así, que los puntos de fusión y ebullición van a
aumentar a medida que se incrementa el número de
átomos de carbono. |
| |
Los alcanos que se presentan a la izquierda,
tienen el mismo número de carbonos pero sus
puntos de ebullición son distintos. Esto se debe
a que la superficie efectiva de contacto entre
dos moléculas disminuye cuanto más ramificadas
sean éstas. Las fuerzas intermoleculares son
menores en los alcanos ramificados por ello
tienen puntos de ebullición más bajos. |
|
Isomeros C5H12 |
Puntos de
ebullición |
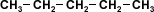 |
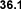 |
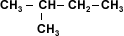 |
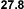 |
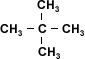 |
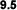 |
|
Punto de Fusión |
Punto de
fusión: El punto de fusión también aumenta
con el tamaño del alcano por la misma razón que
aumenta el punto de ebullición. Los alcanos con
número impar de carbonos se empaquetan en una
estructura cristalina y poseen puntos de
ebullición un poco menores de lo esperados en
los pares. |
| Densidad: a medida
que aumenta el número de carbonos, las
fuerzas intermoleculares son mayores y por
lo tanto la cohesión intermolecular. Esto da
como resultando un aumento de la proximidad
molecular y, por tanto, de la densidad. |
Densidad del estado liquido |
Solubilidad: Los alcanos por ser
compuestos apolares no se disuelven en agua,
sino en solventes no polares como el benceno,
éter y cloroformo. |
A temperatura ambiente es posible encontrar
alcanos en diferentes estados físicos así:
- De metano a butano son
gaseosos.
- De pentano a hexadecano
son líquidos
- De heptadecano en
adelante son sólidos.
|
|
Propiedades químicas
|
Oxidación completa (Combustión):
los alcanos se oxidan en presencia de aire u
oxígeno y el calor de una llama, produciendo
dióxido de carbono, luz no muy luminosa y calor.
Ese calor emitido puede ser calculado y se
denomina calor de combustión. |
Consideremos la combustión de gas etano (C2H6).
Esta reacción consume oxígeno (O2) y
produce agua (H2O) y dioxido de
carbono (CO2). La ecuación química es
la siguiente:
|
|
Si contamos el número de átomos de cada
elementos de los compuestos reaccionantes y de
los productos notaremos que en la ecuación hay
dos veces más átomos de carbono en los reactivos
que en los productos: |
Para solucionar y acercarnos teóricamente a lo
que sucede en la realidad, debe realizarse el
balanceo de la ecuación, esto puede realizarse
de la siguiente manera con base en el número de
carbonos del alcano: |
Ejemplo:
Una vez balanceada la ecuación es posible calcular el calor de
combustión ( ) en
Kcal/mol de un alcano. ) en
Kcal/mol de un alcano.
Calor de
Combustión (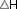 )
se expresa en Kcal/mol. Para calcular el )
se expresa en Kcal/mol. Para calcular el
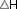 de un alcano se multiplica el número de
electrones de valencia por la constante
26,05 Kcal/mol.
de un alcano se multiplica el número de
electrones de valencia por la constante
26,05 Kcal/mol. |
|
El número de electrones de valencia se calcula
sumando los electrones de valencia de los
hidrógenos + los electrones de valencia de los
carbonos. Así: el hidrógeno tiene 1 electrón de
valencia.El carbono tiene 4 electrones de
valencia. |
Como un alcano tiene n carbonos y su fórmula
general es CnH2n+2 : |
4 x n x 1 x
(2n+2) para luego sumar:
4n + 2n + 2 |
De la ecuación resulta que el número de
electrones de valencia para los alcanos es igual
a 6n + 2.
|
Así para calcular el calor de combustión de un
alcano.
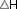 :
cantidad producida al quemar un mol del
compuesto, basta aplicar la fórmula: :
cantidad producida al quemar un mol del
compuesto, basta aplicar la fórmula:
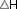 = (6n
+ 2) x 26,05 Kcal/mol = (6n
+ 2) x 26,05 Kcal/mol |
Para calcular el calor de combustión del etano:
n=2
6n + 2 = 6 x 2 + 2 = 14
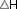 = 14
x 26,05 = 346,7 Kcal/mol. = 14
x 26,05 = 346,7 Kcal/mol. |
| |
Pirólisis o cracking: este es un proceso
usado en la industria petrolera y consiste en
pasar un alcano pesado por tubos calentados de
500 º a 800 ºC lo que permite que el compuesto
se descomponga en alquenos e hidrógeno.
|
|
Halogenación: Los alcanos reaccionan con
los halógenos, en presencia de luz solar o
ultravioleta desde 250ºC hasta 400 ºC,
produciendo derivados halogenados al sustituir
uno o más hidrógenos por átomos del halógeno.
|
La halogenación ocurre en tres etapas que se
ejemplificaran con la reacción de cloración del
metano: |
Primera etapa: la energía luminosa o
calórica produce la disociación de la molécula
de cloro en dos átomos. |
(58 Kcal) indica la cantidad de
energía necesaria para romper el enlace. |
Segunda etapa: sustitución del hidrógeno
por el cloro
|
Tercera etapa: Se unen los radicales libres.
|
|
Ecuación neta:
|
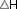 = -
25 Kcal por cada mol de metano convertido en
cloro-metano, siendo por lo tanto una reacción
exotérmica. = -
25 Kcal por cada mol de metano convertido en
cloro-metano, siendo por lo tanto una reacción
exotérmica.
|
Nitratación: Los alcanos en estado
gaseoso reaccionan con vapores de ácido nítrico
a 420ºC para producir nitroderivados, la acción
fuertemente oxidante del ácido nítrico
transforma gran parte del alcano en dióxido de
carbono y agua.
|
Cicloalcanos:
Propiedades físicas: Tienen puntos de
ebullición y puntos de fusión más altos y
densidades mayores que los correspondientes
alcanos acíclicos lineales, debido probablemente
a su mayor rigidez y simetría que permiten unas
fuerzas intermoleculares de atracción (London)
más efectivas. |
Punto de Ebullición |
Punto de fusión |
Densidad |
Los Alquenos u olefinas: constituyen una
serie homóloga que se caracteriza por la
presencia de un doble enlace entre sus carbonos,
lo que los distingue como hidrocarburos
insaturados. |
|
Propiedades físicas de los alquenos: las
propiedades físicas de los alquenos son
semejantes a la de los alcanos. Al igual que los
alcanos pueden encontrarse compuestos en estado
gaseoso como el eteno, 1-buteno y sus isómeros
son gaseosos. A partir de 5 carbonos los
compuestos son líquidos. |
Polaridad de la molécula |
Cis-2- butano.Momento
bipolar neto |
Trans-2-buteno
Momento bipolar nulo |
La polaridad de la molécula depende de la
estereoquímica del alqueno. En los isómeros
geométricos, el isómero Cis, por ser más polar y
acomodarse más perfectamente en el retículo
cristalino, generalmente presenta punto de
ebullición más elevado y punto de fusión menor
que el isómero Trans. |
Propiedades Químicas de los alquenos: Los
alquenos no se pueden catalogar como ácidos pero
sus propiedades ácidas son un millón de veces
mayores que las de los alcanos. En las
reacciones químicas a la derecha, se observa un
mayor desplazamiento del equilibrio por perdida
de protones del etileno (K=10-44), en
comparación con el etano (K= 10-50)
|
|
El etileno permite preparar unos 50
derivados simples de gran importancia
industrial, de los que los más importantes, en
miles de toneladas anuales de producción.
|
Propiedades Físicas de los Alquinos: Los
alquinos tienen propiedades físicas parecidas a
los alcanos y alquenos correspondientes, como se
observa en la siguiente tabla:
|
Compuesto |
Punto de fusión
ºC |
Punto de
ebullición ºC |
Energía de
enlace distintivo |
|
Butano
|
-138,3 |
-0,5 |
C-C: 83 Kcal/mol |
|
1-buteno
|
-185,0 |
-0,3 |
C=C: 173 Kcal/mol |
|
1-butino
|
-122,5 |
8,1 |
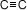 :
229 Kcal/mol :
229 Kcal/mol |
|
Los alquenos pueden encontrarse como gases a
temperatura ambiente como el etino, el propino y
el 1-butino. A partir del 2-butino los alquinos
son líquidos. Son menos insolubles en agua que
los alcanos y los alquenos, esto debido a una la
atracción que experimentan los átomos de
hidrógeno del agua por los electrones del triple
enlace. |
El conocimiento de las propiedades físicas y
químicas tiene importancia práctica no sólo en
el manejo de las sustancias en el laboratorio,
sino también en la industria y el hogar o donde
se manipulan compuestos químicos. El acetileno
por ejemplo es el alquino más inestable, lo que
hace difícil su almacenamiento, cuando se somete
a presión o a la presencia de cobre se desdobla
en sus elementos constitutivos generando una
fuerte explosión. |
Propiedades químicas de los alquinos: los
alquinos terminales se comportan como ácidos
porque, en presencia de bases fuertes, pueden
ceder un protón. |
Por ejemplo: El amiduro sódico puede arrancar el
protón de un acetileno.
|
| |
REFERENCIAS
Requena, L. Vamos a Estudiar Química Orgánica.
(2001). Ediciones ENEVA |