|
Nomenclatura química
Actualmente existen tres tipos de nomenclatura:
la Stock en honor al químico Alemán Alfred
Stock, la nomenclatura tradicional y la
establecida por la I.U.P.A.C. (Unión
Internacional de Química Pura y Aplicada),
llamada también funcional o sistemática, con el
tiempo se espera que esta última sustituya el
uso de los otros sistemas de nomenclatura.
Para aplicar los sistemas de nomenclatura es
importante conocer los grupos de compuestos
donde ésta será aplicada. En este tema se
estudiará la nomenclatura de los compuestos
inorgánicos.
Compuestos inorgánicos:
Los compuestos inorgánicos se agrupan en
funciones químicas, las cuales se caracterizan
por un átomo o grupo de átomos que siempre está
presente.
|
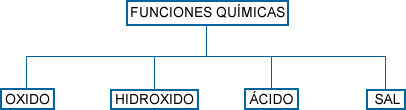
(Explora el Flujograma) |
| Existen
algunos convencionalismos que han sido adoptados
para escribir la fórmula de las diferentes
funciones químicas: |
1. Para escribir la fórmula de los óxidos,
ácidos y sales se acostumbra a escribir los
símbolos de los elementos de los componentes en
orden, según su electronegatividad el más
electronegativo siempre va a la derecha, como en
los siguientes ejemplos donde el átomo más
electronegativo es el O2- y el Cl-: |
|
|
2. Escribir a la izquierda el ión positivo o
catión y a la derecha el ión negativo o anión,
como se observa en el siguiente ejemplo: |
Los cationes corresponden a elementos metálicos,
tienen un número de oxidación positivo (+) y los
aniones corresponden a los no metales, con un
número de oxidación negativo (-). La carga
eléctrica aparece en la parte superior derecha
del símbolo y corresponde al número de oxidación
de cada elemento. Los números de oxidación
permiten escribir las fórmulas químicas, la
predicción de las propiedades de los compuestos
y son de ayuda en el balanceo de ecuaciones de
óxido reducción.
- Ejemplo de algunos cationes
|
Cationes |
| Nombre |
Símbolo |
Nombre |
Símbolo |
|
Hidrógeno |
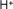 |
Aluminio |
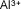 |
| Litio |
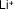 |
Cobre (I) o
cuproso |
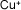 |
| Sodio |
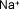 |
Cobre (II) o
cúprico |
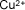 |
| Potasio |
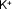 |
Hierro (II) o
ferroso |
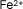 |
| Calcio |
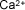 |
Hierro (III) o
férrico |
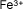 |
| Magnesio |
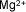 |
Plomo (II) o
plumboso |
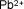 |
| Cinc |
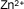 |
Plomo (IV) o
plúmbico |
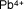 |
| Bario |
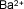 |
Mercurio (I) o
mercurioso |
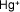 |
| Plata |
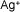 |
Mercurio (II) o
mercúrico |
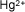 |
| Estroncio |
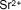 |
|
|
. Ejemplo de algunos aniones. |
|
Aniones |
|
Nombre |
Símbolo |
| Fluoruro |
 |
| Cloruro |
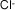 |
| Bromuro |
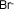 |
| Yoduro |
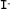 |
| Sulfuro |
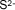 |
| Oxígeno |
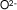 |
Compuestos inorgánicos
binarios: Los compuestos binarios
contienen dos elementos distintos y corresponden
a las funciones de óxido metálico, óxido no
metálico, ácido hidrácido y sal binaria. A
continuación se presenta cómo se forma cada una
de estas funciones: |
Óxido Metálico:
se forma al combinarse un metal con el oxígeno |
|
|
Óxido No metálico: se forma al combinarse
un no metal con el oxígeno |
Sal Binaria: se
forma al combinarse un metal con un no metal: |
|
|
|
Ácido Hidrácido:
Se forma al combinarse un a molécula de
Hidrógeno con un no metal. |
|
|
Para nombrar los óxidos se utiliza la palabra
óxido, seguida del nombre específico del metal,
por ejemplo
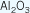 óxido de aluminio.
óxido de aluminio.
Cuando un elemento presenta un número de
oxidación variante como por ejemplo el cobre
pueden aplicarse diferentes normas como se
observa en el siguiente cuadro donde se aplican
los 3 sistemas de nomenclatura:
| Compuesto |
Nomenclatura Stock |
Nomenclatura sistemática |
Nomenclatura tradicional |
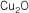
|
óxido de cobre (I) |
monóxido de
dicobre |
óxido cuproso |
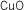
|
óxido de cobre
(II) |
monóxido de cobre |
óxido cúprico |
|
| En el sistema Stock se
escribe el nombre genérico, en este caso óxido,
seguido por la preposición de y el nombre del
elemento. Adicionalmente, entre paréntesis se
escribe en número romanos el número de oxidación
del elemento unido al oxígeno. Si el elemento
tiene un solo número de oxidación, se omite el
número romano dentro de un paréntesis. |
|
|
|
En la nomenclatura sistemática para los óxidos
se utiliza el prefijo numeral mono, di, tetra,
penta, hexa, etc., para designar el número de
oxígenos, seguido de la palabra óxido y el
número de átomos del otro elemento. |
La nomenclatura tradicional, utiliza los sufijos
ico y oso y los prefijos hipo y per de la
siguiente manera: si el elemento presenta dos
números de oxidación, se utiliza ico para el
mayor número de oxidación del elemento que
acompaña el oxígeno y oso para el menor. (Observa
el ejemplo de la derecha) |
|
|
Función hidrácido: Estos ácidos se forman
por la combinación de los halógenos (F, Cl, Br,
I) o el azufre (S) con el Hidrógeno. |
Para nombrar a
estos compuestos se antepone la palabra ácido,
luego el nombre específico del no metal y
sustituyendo la última vocal del compuesto por
el sufijo hídrico. (ver tabla)
| |
H+ |
|
| F- |
HF |
Ácido fluorhídrico |
| Cl- |
HCl |
Ácido clorhídrico |
| Br- |
HBr |
Ácido Bromhídrico |
| I- |
HI |
Ácido iodhídrico |
| S2- |
H2S |
Ácido sulfhídrico |
|
|
Función sal binaria: Se forman por la
combinación de un ácido hidrácido más un metal (catión)
el cual reemplaza al hidrógeno del ácido
hidrácido. |
La mayoría de estos compuestos tienen un metal o
un no metal. Para nombrarlos se menciona el
nombre del no metal agregando el sufijo uro
seguido del nombre del metal. |
|
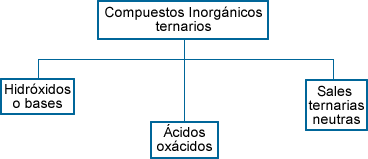
Compuestos ternarios: Estos
compuestos están formados por 3 elementos
químicos: un catión (H2 o un no
metal) un ión negativo poliatómico que
corresponde a las funciones de hidróxido o base,
ácido oxácido y una sal ternaria neutra. |
Para dar el nombre al compuesto ternario se
menciona primero el grupo poliatómico (radical)
negativo y en seguida se menciona el nombre del
catión. Para nombrar estos compuestos es
necesario conocer el nombre de los iones
poliatómicos. |
|
Función hidróxido o
base: Se forman por la combinación de un
ión (OH-) con un catión metálico. Los
iones (OH-) son llamados oxidrilos,
hidroxilos o hidróxidos. |
Los hidróxidos provienen de reacciones entre un
óxido metálico con el agua dando origen a una
base constituida por un metal y el grupo
hidroxilo. |
|
En la siguiente tabla se presentan ejemplos de
hidróxidos y su nombre usando los tres sistemas
de nomenclatura. (ver tabla)
| Fórmula |
Stock |
Sistemática |
Tradicional |
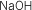 |
Hidróxido de sodio |
Hidróxido de sodio |
Hidróxido de sodio |
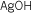 |
Hidróxido de plata |
Hidróxido de plata |
Hidróxido de plata |
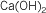 |
Hidróxido de
calcio |
Dihidróxido de
calcio |
Hidróxido de
calcio |
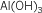 |
Hidróxido de
aluminio |
Trihidróxido de
aluminio |
Hidróxido de
aluminio |
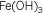 |
Hidróxido de
hierro (III) |
Trihidróxido de
hierro |
Hidróxido férrico |
|
|
|
La nomenclatura Stock, utiliza el nombre
genérico (hidróxido) y el nombre del metal,
colocando adicionalmente entre paréntesis en
números romanos el número de oxidación del
elemento unido al OH-, cuando se
trata de elementos con más de un número de
oxidación. Esto se omite cuando el elemento
tiene un solo número de oxidación. |
El sistema tradicional comienza con el nombre
del hidróxido y luego va la terminación oso si
se trata del menor número de oxidación e ico si
se trata del mayor número de oxidación. Si el
elemento tiene un solo número de oxidación,
simplemente se utiliza el número del metal. |
|
|
|
La nomenclatura sistemática utiliza los prefijos
di, tri, tetra, etc., si la fórmula presenta
dos, tres o cuatro grupos OH-
respectivamente y así sucesivamente en caso de
presentar más. Las normas sistemáticas
establecidas por la IUPAC vienen recomendándose
para su aplicación a fin de sustituir
progresivamente al sistema de nomenclatura
tradicional. |
Función ácido oxácido:
Están formados por un catión H+ unido
a un ión poliatómico (radical) negativo. Los
ácidos oxácidos se forman a partir de la
combinación de los óxidos metálicos con el agua.
|
|
En el siguiente cuadro se observan algunos
ácidos oxácidos y su nombre en los 3 sistemas de
nomenclatura: (ver tabla)
| Fórmula |
Stock
Ácido Oxácido |
Sistemática Ácido Oxácido |
Tradicional Ácido Oxácido |
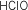 |
Oxoclórico I |
Oxoclorato I de
hidrógeno |
hipocloroso |
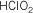 |
Dioxoclórico III |
Dioxoclorato III
de hidrógeno |
cloroso |
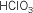 |
Trioxoclórico V |
Trioxoclórato V de
hidrógeno |
clórico |
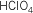 |
Tetraoxoclórico
VII |
Tetraoxoclorato
VII de hidrógeno |
perclórico |
|
|
|
La nomenclatura Stock adiciona la palabra ácido,
el prefijo respectivo según la cantidad de
oxígeno (Di, Tri, Tetra, etc), seguido de la
palabra oxo y la raíz del nombre correspondiente
del elemento no metálico diferente del hidrógeno
y del oxígeno con la terminación ico y su número
de oxidación en números romanos. |
Para determinar el número de oxidación en los
oxácidos se siguen los siguientes passos:
1. Se escriben números de oxidación conocidos,
que no varían:
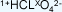 en este caso del hidrógeno y del oxígeno. El
número del cloro es el desconocido (x) puesto
que puede variar.
en este caso del hidrógeno y del oxígeno. El
número del cloro es el desconocido (x) puesto
que puede variar.
2. Se multiplican los subíndices por el número
de oxidación de los elementos que no varían:
3.
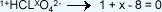
4. Se despeja
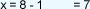
7 es el número de oxidación del cloro, porque la
suma de las cargas iónicas es igual a cero,
equivale a decir que tiene que haber tantas
cargas positivas como negativas. Por eso el
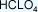 aparece
en la nomenclatura Stock con un número VII para
indicar el número de oxidación del cloro. aparece
en la nomenclatura Stock con un número VII para
indicar el número de oxidación del cloro.
|
En la nomenclatura sistemática se da el nombre
del ión y luego se complementa con la expresión
de hidrógeno. |
|
|
|
En la nomenclatura tradicional se el compuesto
se nombrará con la palabra ácido y se hace uso
de los sufijos oso o ico y de los prefijos hipo
o per, si existen más de dos oxácidos de ese
elemento. |
En el siguiente cuadro se muestra la
nomenclatura cuando el cloro actúa con sus
diferentes valencias.
(ver tabla)
| Valencia del Cloro |
Compuesto |
Nomenclatura |
| +1 |
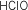 |
Ácido hipocloroso |
| +3 |
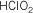 |
Ácido cloroso |
| +5 |
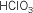 |
Ácido clórico |
| +7 |
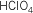 |
Ácido perclórico |
|
| |
Función Sal:
existen cuatro tipos:
Las sales básicas que pueden obtenerse cuando:
a) Se sustituye
el grupo hidroxilo (OH-) de una base,
total o parcialmente.

b) Se sustituyen
parcialmente los átomos metálicos de una sal
neutra por grupos hidroxilo (OH-).
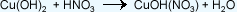
|
Sales ácidas: se
forman cuando los elementos metálicos no
reemplazan la totalidad de los hidrógenos
catiónicos. |
|
|
|
Sales dobles: se
forman cuando más de un elemento metálico (catión)
sustituye a los hidrógenos del ácido. |
Sales neutras: se
forman al reemplazar los hidrógenos catiónicos
de los ácidos por elementos metálicos. |
|
Nomenclatura de las
sales neutras: El nombre que recibe una
sal neutra deriva del ácido del cual se origina,
cambiando sus terminaciones como se indica en la
tabla. (ver tabla)
| Nombre
del Ácido
|
Nombre de
la sal neutra
|
| Ácido Hipocloroso |
Hipo -ito |
| -oso |
-ito |
| -ico |
-ato |
| Per -ico |
Per -ato |
|
|
La nomenclatura tradicional continúa teniendo
una amplia difusión en cuanto a las sales
neutras, en el campo de la industria y los
productos comerciales.(tabla difusión)
| Fórmula |
Nomenclatura tradicional |
Nomenclatura moderna |
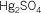 |
Sulfato mercurioso |
TetrosulfatoVI
de mercurio |
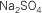 |
Sulfito de sodio |
TriosulfitoVI
de sodio |
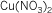 |
Nitrato cuproso |
TrioxonitratoV
de cobre |
|
Ahora que ya conoces los diferentes sistemas de
nomenclatura y las diferentes funciones químicas
de los compuestos inorgánicos busca un producto
de aseo personal tal como shampoo, una crema
dental y lee en la etiqueta los ingredientes
trata de identificar si existen entre los
componentes de este producto algunas de las
funciones inorgánicas que se han mencionado en
este tema y trata de determinar de que tipo de
nomenclatura se trata. Discútelo con tu clase. |
REFERENCIAS
Requeijo, D. y Requeijo A. (2002). Química.
Editorial Biosfera.
Irazábal A. y de Irazábal C. (S/A). Química.
Ediciones CO-BO.
Mahan. Química. (1977). Fondo Educativo
Interamericano |